
【題目】化學與科學技術、生產生活及環境保護等密切相關。
(1)我省啟動保衛碧水藍天的“263“行動,減少煤炭消費總量,減少霧霾天氣的發生。形成硫酸型酸雨的主要氣體是__________;嚴格整治畜禽養殖場污染,主要是為減少_________和P等元素及化學需氧量對水體的污染。
(2)目前正在推廣用尿素水解液來消除柴油汽車尾氣中的氮氧化物。寫出脈素水解液中的NH3與NO在催化劑作用下,反應生成無污染物質的化學方程式____________________________________。
(3)三硅酸鎂 Mg2Si3O8·nH2O具有治療胃酸過多的作用,寫出其與酸反應生成SiO2·H2O等物質的化學方程式_____________。
【答案】 SO2 N(氮) 6NO+4NH3 ![]() 5N2+6H2O Mg2Si3O8·nH2O+4HCl===2MgCl2 +3SiO2·H2O+(n-1)H2O
5N2+6H2O Mg2Si3O8·nH2O+4HCl===2MgCl2 +3SiO2·H2O+(n-1)H2O
【解析】(1)根據造成酸雨的原因以及造成水體污染的主要原因來分析;(2)(3)根據反應物、生成物、反應條件寫出反應的化學方程式;(1)二氧化硫是形成硫酸型酸雨的主要氣體;嚴格整治畜禽養殖場污染,主要是為減少氮元素與磷元素及化學需氧量對水體的污染;(2)在催化劑存在的條件下,氨氣與NO反應生成無毒的N2和H2O,反應的化學方程式為4NH3+6NO![]() 5N2+6H2O;(3)三硅酸鎂Mg2Si3O8·nH2O與HCl反應生成MgCl2、SiO2·H2O、H2O,反應的化學方程式為Mg2Si3O8·nH2O+4HCl=2MgCl2 +3SiO2·H2O+(n-1)H2O。
5N2+6H2O;(3)三硅酸鎂Mg2Si3O8·nH2O與HCl反應生成MgCl2、SiO2·H2O、H2O,反應的化學方程式為Mg2Si3O8·nH2O+4HCl=2MgCl2 +3SiO2·H2O+(n-1)H2O。


 優質課堂快樂成長系列答案
優質課堂快樂成長系列答案科目:初中化學 來源: 題型:
【題目】恩施州內的很多景點都已經在全國乃至世界享有盛名,如“騰龍洞”、“恩施大峽谷”等;而形成這些奇谷異洞的根本原因與當地的石灰石有關。某中學的“化學興趣小組”為了測定“騰龍洞”內石灰石樣品中CaCO3的含量。取8g樣品研碎后放入燒杯中,再加入100g稀鹽酸恰好完全反應后,燒杯中剩余物質105.8克(假設樣品中雜質不溶也不反應,不考慮水的蒸發及CO2的溶解等因素,結果保留百分號前一位小數)。試計算:
(1)樣品中CaCO3的質量分數是多少_________?
(2)所得溶液中溶質的質量分數是多少_________?
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】鈣及其化合物在生產、生活中具有廣泛的應用
(一)鈣及其化合物的應用
(1)青少年缺“鈣”易患的疾病是________。
(2)混凝土中也含有一定量的含鈣物質,鋼筋與混凝土混合形成鋼筋混凝土,以上敘述中不涉及的材料是_________。 a.無機材料 b.合成材料 c.復合材料
(3)即熱型快餐加熱原理是利用生石灰和水反應放熱,用方程式表示其反應__________。
(二)過氧化鈣(CaO2)的性質
(1)CaO2中氧元素的化合價為_____________。
(2)CaO2能與稀鹽酸發生復分解反應,反應的化學方程式為_____________。
(3)魚類長途運輸的增氧劑的主要成分為CaO2,它與水緩慢反應生成O2,還生成一種堿,其化學式為_______,Na2O2也能與水反應,原理與CaO2相同,但卻不能作為魚蝦運輸的供氧劑,請分析可能的原因___________________。
(三)過氧化鈣晶體的制備
(資料)過氧化鈣晶體(CaO2·yH2O),常溫為白色,能溶于酸,難溶于酒精。
制備原理:CaCl2+H2O2+NH3+H2O ![]() CaO2·yH2O↓+NH4Cl,裝置如下。
CaO2·yH2O↓+NH4Cl,裝置如下。

(1)裝置A中試管內發生反應的化學方程式為______________________。
(2)裝置C采用冰水浴控制溫度在0℃左右,可能的原因主要有:
Ⅰ. 該反應是放熱反應,溫度低有利于提高CaO2·yH2O產率;
Ⅱ. _____________________________。
(3)反應結束后,經過濾、洗滌、低溫烘干可獲得CaO2·yH2O。
①洗滌時采用95%的酒精溶液洗滌的優點是_________________。
②檢驗晶體已洗滌干凈的方法為________________________。
(四)過氧化鈣晶體組成的測定
稱取21.6克晶體用熱分析儀對其進行熱分解實驗,并繪制成固體質量與溫度關系圖(過氧化鈣晶體受熱時會先失去結晶水)

(1)0—150℃質量不發生改變的原因是______________________。
(2)根據上圖可知y=________。
(3)350℃時發生反應的化學方程式為_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】在一燒杯中盛有2.4g金屬鎂,向其中加入一定質量的稀硫酸,充分反應后,向所得溶液中逐滴滴入未知溶質質量分數的氫氧化鈉溶液,產生沉淀與滴入氫氧化鈉溶液的質量關系曲線如圖所示。
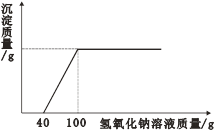
(1)完全反應后,產生沉淀的質量為________g;
(2)氫氧化鈉溶液中溶質的質量分數是_________?(寫出計算過程,結果精確到0.1%)
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】生物體中含有多種氨基酸(結構如圖所示)。下列有關敘述正確的( )
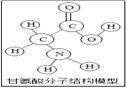
A. 甘氨酸是有機高分子化合物
B. 一個甘氨酸分子中含有10個原子
C. 甘氨酸是由碳、氫、氧、氮四種原子構成的
D. 甘氨酸中碳元素與氧元素的質量比為1:1
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】碳、硫的含量影響鋼鐵性能、某興趣小組用如下流程對鋼樣進行探究。
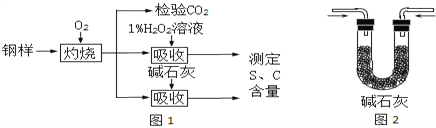
(1)鋼樣中硫元素以FeS形式存在,FeS在足量氧氣中灼燒生成兩種氧化物,其中一種是固體,固體產物中Fe、O元素的質量比為21:8,則該固體產物的化學式為_________。灼燒的反應方程式為_________;
(2)鋼樣灼燒生成的氣體是___________和___________,檢驗前者需要的試劑是_______________,檢驗后者需要的試劑是_____________________;
(3)取10.00g鋼樣在足量氧氣中充分灼燒,將生成的氣體用適量1%的H2O2溶液充分吸收,吸收液呈現酸性,用10g0.8%的NaOH溶液恰好將吸收液中和至中性;另取10.00鋼樣在足量氧氣中充分灼燒,將生成的氣體通過盛有足量堿石灰的U型管(如圖2),堿石灰增重0.614g。
①用1%H2O2溶液吸收SO2,發生化合反應,化學方程式為_________________________________;
②分別計算該鋼樣中硫、碳元素的質量分數(寫出計算過程)_______________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】ZnSO4飽和溶液的溶質質量分數隨溫度變化的曲線如圖所示。下列說法正確的是

A. N點對應的ZnSO4溶液升溫或降溫均都可能析出晶體
B. M點對應的ZnSO4溶液是不飽和溶液
C. ZnSO4飽和溶液的溶質質量分數隨溫度升高而增大
D. 40℃時,ZnSO4的溶解度為41g
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】化學實驗操作的規范性、安全性是實驗成敗的關継,同時也反映了實驗者的化學素養。下列如圖所示的實驗操作正確的是
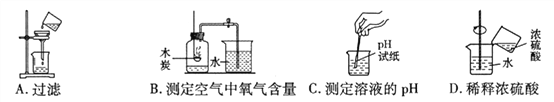
A. A B. B C. C D. D
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某純堿廠生產的某批次碳酸鈉產品中可能含有氯化鈉雜質。
定性檢驗
(1)要確定該產品中是否含有雜質氯化鈉,你的方法是_________________。
定量測定:
(2)若利用沉淀法測定該產品中碳酸鈉的質量分數,你確定的反應原理是(用化學方程式表示)_______________________________。
(3)假設你取樣的質量為m1,根據你確定的反應原理,你需要通過實驗測量沉淀(填化學式)____的質量(假設你測得的沉淀的質量為m2)。
(4)請你設計實驗方案,獲得數據m1、m2,把方案填在下表中。
適用的儀器名稱 | 實驗步驟 |
____________ | ______ |
(5)數據處理:
請用含m1、m2的式子表示所測樣品中碳酸鈉的質量分數,______________________。
分析討論:
(6)要測定混合物中某成分的含量,可通過化學方法將不易測定的物質轉化為易測量的物質。除沉淀法外,還可依據反應(用化學方程式表示)_______________來測定該純堿樣品中碳酸鈉的質量分數。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com