
【題目】下圖是甲、乙、丙三種固體物質的溶解度曲線,且它們溶于水時溶液溫度均無明顯變化。
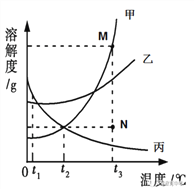
(1)t3℃時,N點的丙溶液為________溶液(飽和或不飽和)
(2)t2℃時,等質量的甲、乙兩種物質的飽和溶液中溶劑的質量大小關系為甲________乙(填“>”、“<”或“=”)。
(3)t3℃時,若要將N點的甲溶液轉變為M點的甲溶液,可以采用的方法是_____________________;__________________。
(4)t3℃時,M點對應的溶解度為50g,此點甲溶液的質量分數是________(保留一位小數)。
 小學期末沖刺100分系列答案
小學期末沖刺100分系列答案 期末復習檢測系列答案
期末復習檢測系列答案 超能學典單元期中期末專題沖刺100分系列答案
超能學典單元期中期末專題沖刺100分系列答案 黃岡360度定制密卷系列答案
黃岡360度定制密卷系列答案科目:初中化學 來源: 題型:
【題目】為了達到相應的實驗目的,下列實驗設計部不合理的是
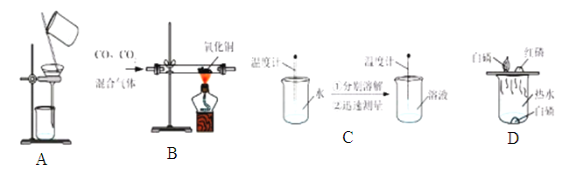
A.分離H2O2和MnO2制O2后的固液混合物 B.除去CO中的CO2氣體
C.區分NaCl、NH4NO3、NaOH三種固體 D.探究可燃物燃燒的條件
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】同學們對制作糕點常用膨松劑Na2CO3或NaHCO3進行了下列探究。
【查閱資料】
溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
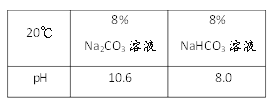
【探究一】NaHCO3和Na2CO3性質差異的探究
(1)現有20℃時溶質質量分數為8%的Na2CO3和NaHCO3溶液酸堿性:取樣于試管中,分別滴加紫色石蕊試液,均顯_____色;酸堿度:NaHCO3溶液________Na2CO3溶液(填“>”或”“<”)。
(2)穩定性:按下圖,實驗中可觀察乙燒杯中的石灰水變渾濁,甲燒杯不變,則乙燒杯中發生反應的化學方程式為:___________________________。結論:在受熱條件下,碳酸鈉比碳酸氫鈉穩定性______(填“強”或“弱”)。
(3)利用溶解度鑒別NaHCO3和Na2CO3:分別取Xg兩種固體粉末加入20℃,10g水中充分溶解,通過觀察溶解現象來區分,X可以是下列的_______。(選填A、B或C)
A.1.5g B.0.96g C.0.5g
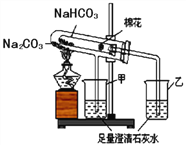
【探究二】測定NaHCO3和Na2CO3混合物10.0g中NaHCO3的質量分數(下圖,夾持裝置略)
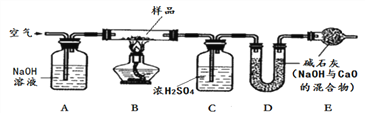
【問題討論】
(4)實驗前先通一段時間的空氣的目的是____________________;
(5)A的作用是_____________________________,若沒有裝置E,NaHCO3的質量分數測定結果會_____________(填“偏大”、“不變”或“偏小”)。
(6)停止加熱后,仍繼續通入空氣一段時間,目的是___________________。
【含量測定】
(7)測得裝置D的質量實驗前為120.2g,實驗后為122.4g,計算該樣品中NaHCO3的質量分數。(要有計算過程)______________________
【知識拓展】
(8)向飽和的氯化鈉溶液中通入氨氣和二氧化碳,經過一系列變化,也可制得Na2CO3和一種銨鹽。該反應的化學反應方程式為:_______________________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】現有A、B、C、D、E五種溶液,它們分別是氫氧化鈉溶液、硫酸銅溶液、碳酸鈉溶液、氯化鈉溶液和稀硫酸中的一種。鑒別它們可按下圖所示的步驟進行,回答下列問題
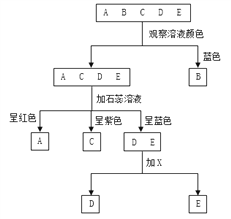
(1)溶液A、B、C中的溶質分別是A_________,B_________,C_________。(填化學式)
(2)用X鑒別D、E時,X可以選用不同的物質。
①若X為稀鹽酸,寫出有氣體生成的反應的化學方程式____________________;
②若X為氯化鈣溶液,寫出有沉淀生成的反應的化學方程式____________________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某化學實驗活動小組的同學為了探究實驗室中久置的氫氧化鈉固體的成分,進行了有關實驗,請你參與他們進行的探究活動:
【猜想與假設】
猜想Ⅰ:全部是NaOH;
猜想Ⅱ:全部是Na2CO3;
猜想Ⅲ:_________________________。
【實驗與探究】
實驗操作步驟 | 實驗現象 | 結論及解釋 |
步驟一:取少量固體樣品于試管中,加蒸餾水完全溶解,然后加入足量的稀鹽酸。 | 若實驗過程中始終沒有氣泡產生。 | 則證明猜想___成立。 |
步驟二:取少量固體樣品于試管中,加蒸餾水完全溶解,然后滴加氫氧化鋇溶液。 | 若實驗過程中產生___________。 | 則證明猜想Ⅱ或Ⅲ成立,此過程中發生反應的化學方程式為______________。 |
(1)設計如下實驗:
(2)為了進一步驗證猜想結果,小明同學提出了如下實驗方案:在完成步驟二的實驗后,過濾,然后向濾液中滴加無色酚酞試液,若酚酞變紅,則猜想Ⅲ成立;若酚酞不變紅,則猜想Ⅱ成立。
小華同學立即對小明同學的方案提出了質疑,通過查閱資料知道:氯化鋇溶液呈中性。因此氯化鋇溶液不能使無色酚酞試液變紅,但碳酸鈉溶液呈_____性(填“酸”或“堿”),能使酚酞試液變紅。所以,他認為該實驗方案中應改進的是______________。
(3)實驗小組的同學展開討論,又提出了一個定量實驗方案,通過測定產生沉淀的質量來證明猜想Ⅱ或Ⅲ成立。實驗如下:準確稱量m克固體樣品于試管中,加入蒸餾水完全溶解,然后滴加足量氯化鈣溶液,充分反應后過濾、洗滌、干燥稱得沉淀的質量為n克,若猜想Ⅱ成立,則m與n的關系式為(用含m和n的等式或不等式表示,下同)_________;若猜想Ⅲ成立,則m與n的關系式又為________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某氣體只能用排水法收集(下圖),下列說法正確的是
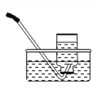
A. 當導管口開始有氣泡冒出時立即收集
B. 當集氣瓶口冒出大量氣泡時停止收集,取出,再用玻璃片粗糙面蓋上
C. 當集氣瓶口冒出大量氣泡時停止收集,在水下用玻璃片光滑面蓋上, 取出
D. 該氣體具有的性質是:不易(或難溶于水);密度與空氣接近或與空氣中的成分反應
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】化學是一門以實驗為基礎的科學,請根據下列所示的示意圖回答問題。
(1)實驗1中,集氣瓶內進入水的體積約為集氣瓶中空氣總體積的___________。
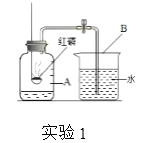
(2)實驗2中,把干燥的紫色石蕊紙花和濕潤的紫色石蕊紙花分別伸入兩瓶干燥的二氧化碳氣體中,可以觀察到_________(填“干燥的紫色石蕊紙花”或“濕潤的紫色石蕊紙花”)變紅的現象,則其變紅原因是____(請用化學方程式表示)。

(3)實驗3中,若B處盛放木炭,分別進行以下操作:Ⅰ.先在A處通入氮氣一段時間后,再在B處加熱,B、C處沒有明顯變化;Ⅱ.待B處冷卻至室溫,在A處通入氧氣一段時間后,B、C處沒有明顯變化;Ⅲ.在A處繼續通入氧氣,然后在B處加熱,發現木炭燃燒,C處變渾濁。則Ⅱ與Ⅲ對比,說明物質燃燒的條件之一是____________。
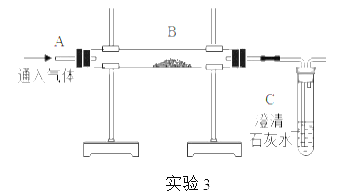
(4)實驗3中,若B處盛放氧化鐵粉末,分別進行以下操作:先在A處通入一氧化碳,一段時間后,再在B處的下方通過使用酒精噴燈獲得高溫,B處可以觀察到紅色粉末逐漸變黑的現象,發生反應的化學方程式為________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】請根據下列裝置,回答問題:
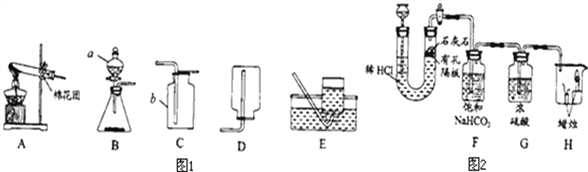
(1)寫出圖1中有標號儀器的名稱: b______.
(2)①用高錳酸鉀制取一瓶氧氣,可選用裝置A和______(選填序號)組合.裝入藥品前要先______;實驗所用高錳酸鉀工業上可用高純度的二氧化錳為原料制取,主要流程如下:
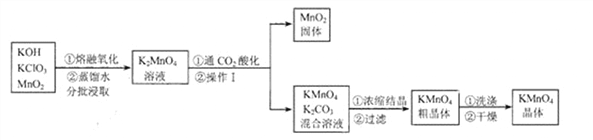
已知相關物質的溶解度(20℃)如下表:

②流程里K2MnO4中錳元素的化合價為__________。
③操作I的名稱是_____。“干燥”過程中溫度不宜過高的原因是_________________(用化學方程式表示)。
④“通CO2酸化”,反應的化學方程式為: 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3 若用稀H2SO4酸化,反應的化學方程式為: 3K2MnO4+2H2SO4=2KMnO4 +MnO2↓+2K2SO4+2H2O 工業上不采用稀H2SO4酸化的原因是____________________。
⑤電解法也可以實現由K2MnO4向KMnO4的轉化,反應的化學方程式為:![]() 與“通CO2酸化”相比,其優點是___________。
與“通CO2酸化”相比,其優點是___________。
(3)用雙氧水和二氧化錳制氧氣,二氧化錳的作用是____,可選用的發生裝置是____(填序號)。
(4)用如圖2裝置制取CO2并驗證相關性質。
①生成CO2反應的化學方程式_________,該反應屬_______反應(寫基本反應類型);
②F裝置的作用是______;
③H裝置中的現象可說明CO2具有的性質是______(答一點即可)。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】將質量相同的甲、乙、丙三種金屬粉末與足量的稀硫酸反應(甲、乙、丙在生成物中均為+2價),生成H2的質量與反應時間的關系如圖所示,下列說法錯誤的是
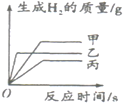
A. 生成氫氣的質量是甲>乙>丙 B. 相對原子質量最大的是丙
C. 金屬活動性順序是乙>甲>丙 D. 消耗硫酸的質量是甲>丙>乙
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com