
【題目】草木灰是一種農家肥,它的主要成分是碳酸鉀,還有硫酸鉀,氯化鉀等。化學興趣小組為測定某草木灰樣品中的有效成分,取50g草木灰于燒杯中,不斷滴入硫酸溶液,當滴入30g硫酸溶液時,不再有氣泡產生,此時燒杯中的殘余混合物的質量為77.8g。(假設草木灰的其他成分不含鉀元素且不與酸反應)
請計算回答:
(1)草木灰的主要成分所屬的物質類別為____________(填“酸、堿或鹽”)。
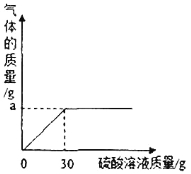
(2)如圖表示反應過程中放出的氣體質量與加入硫酸溶液的關系曲線,請求出圖中縱坐標上a點數值:a=________________g;
(3)計算草木灰樣品中碳酸鉀的質量分數。(要求寫出計算過程)
(4)通過其他實驗,測得該50g草木灰中還含的硫酸鉀質量為8.7g,氯化鉀的質量為1.49g,則該50g草木灰樣品中鉀元素的質量為__________g。
【答案】(1)鹽;(2)2.2(3)13.8%(4)8.58
【解析】
試題分析:(1)根據題意可知,“草木灰是一種農家肥,它的主要成分是碳酸鉀,還有硫酸鉀,氯化鉀等”。其中的碳酸鉀,還有硫酸鉀,氯化鉀均是由金屬離子和酸根離子構成的化合物,屬于鹽類。
(2)a點表示生成氣體的質量的最大值。根據題意可知:該氣體為碳酸鉀與硫酸反應生成的二氧化碳氣體。其質量為:50g(草木灰)+30g(硫酸溶液)—77.8g(殘余混合物)=2.2 g。所以a=2.2 g;
(3)根據題意可知:已知量為生成二氧化碳的質量;未知量為樣品中碳酸鉀的質量分數。
解題思路:可根據二氧化碳與碳酸鉀在反應中的質量,求出碳酸鉀的質量,進一步求出其在樣品中的質量分數。具體過程如下:
解:設草木灰樣品中碳酸鉀的質量為x
K2CO3+H2SO4=K2SO4+CO2↑+H2O
138 44
x 2.2g
138:44=x:2.2g
解得:x=6.9g
碳酸鉀的質量分數=![]() ×100%=13.8%
×100%=13.8%
答:草木灰樣品中碳酸鉀的質量分數為13.8%
(4)草木灰中的鉀元素是碳酸鉀、硫酸鉀和氯化鉀三種物質中的鉀元素的質量和。可分別根據三種物質的化學式求出其中所含鉀元素的質量。具體解題過程如下:
6.9g碳酸鉀(K2 CO3)中含鉀元素的質量為:6.9g×(![]()
![]() ×100%)=3.9g;
×100%)=3.9g;
8.7g硫酸鉀(K2 SO4)中含鉀元素的質量為:8.7g×(![]() ×100%)=3.9g;
×100%)=3.9g;
1.49g氯化鉀(KCl)中含鉀元素的質量為:1.49g×(![]() ×100%)=0.78g;
×100%)=0.78g;
草木灰樣品中鉀元素的質量為3.9g+3.9g+0.78g=8.58 g。


 勵耘書業暑假銜接寧波出版社系列答案
勵耘書業暑假銜接寧波出版社系列答案科目:初中化學 來源: 題型:
【題目】下列圖象中有關量的變化趨勢與對應敘述關系正確的是( )
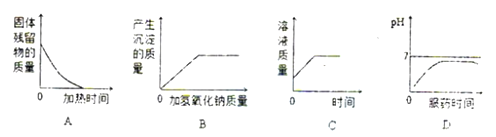
A.一定質量的木炭和氧化銅在高溫條件下反應,殘留固體的質量與加熱時間的關系
B.向一定量鹽酸和氯化鐵混合溶液中滴加過量氫氧化鈉溶液,生成沉淀質量與加入氫氧化鈉質量的關系
C.表示向足量的稀CuCl2中加入少量Fe,溶液質量與時間的關系圖
D.胃酸(鹽酸)過多可服用氫氧化鎂.在氫氧化鎂與胃酸作用的過程中,胃液pH值與服藥時間的變化關系
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】上述兩個反應體現了氧氣__________ 性質。氧氣瓶中的氧氣來自于工業制備,工業上制備氧氣利用分離液態空氣的方法,屬于_____________ 變化。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】(7分)現有某不純的碳酸鈉固體樣品,已知其中含有的雜質可能是Na2SO4、CuSO4、NaCl、CaCl2中的一種或幾種。為確定其雜質的成分,進行如下實驗,出現的現象如圖所示(設過程中所有發生的反應都恰好完全進行)。
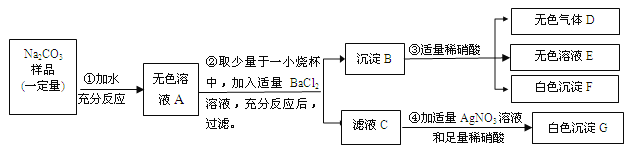
請你根據實驗過程和發生的現象做出分析判斷,并填寫以下空白:
(1)氣體D能使紫色石蕊試液 。
(2)無色溶液E中的酸根離子的符號是 。
(3)該碳酸鈉固體樣品中一定含有的雜質是 ,一定不含有的雜質是 。
(4)請寫出過程④中發生反應的一個化學方程式 。
(5)碳酸鈉固體樣品中還不能確定的物質是 。要確定它是否存在,可另取溶液A再實驗。請簡述你的設計方案(說明實驗操作步驟、發生的現象及結論)。
。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】(7分)下面所示為實驗室中常見氣體制備、干燥、收集和性質實驗的部分儀器(組裝實驗裝置時,可重復選擇儀器)。試根據題目要求,回答下列問題:

(1)若以過氧化氫溶液為原料(二氧化錳作催化劑)在實驗室中制備并收集干燥的氧氣。
①所選儀器的連接順序為_______________(填寫儀器序號字母)。
②生成氧氣時,儀器A中發生反應的化學方程式為 。
(2)若用鋅和稀硫酸反應制取氫氣,并用來測定某不純的氧化銅樣品的純度(雜質為少量單質銅),所選儀器的連接順序為:A→D1→C→D2→D3。(已知:CuO+H2![]() Cu+H2O;D1、D2、D3為3個濃硫酸洗氣瓶)
Cu+H2O;D1、D2、D3為3個濃硫酸洗氣瓶)
①儀器D1的作用是_____________________________________________。
②儀器A中發生反應的化學方程式是 。
③反應完成后,裝置D2中濃硫酸的質量增重1.8g,則氧化銅樣品的純度為 。若不連接D1,則計算出氧化銅樣品的純度將會_____________(填“偏大”、“偏小”或“基本一致”)。
④若通過 的方法,即使不連接D1,計算出氧化銅樣品的純度也會基本一致。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某磁性納米材料X因其特殊的磁學性能,在生物、醫藥、電子器件等領域具有廣泛的應用前景。磁性納米材料X的一種制備方法為:FeCl2+2FeCl3+8NaOH=X+8NaCl+4H2O。該磁性納米材料X的化學式是( )
A. Fe(OH)2 B. Fe(OH)3 C. Fe2O3 D. Fe3O4
查看答案和解析>>
科目:初中化學 來源: 題型:
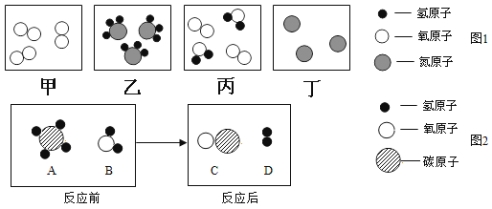
【題目】(6分)在宏觀、微觀和符號之間建立聯系是化學學科的特點。
(1)氯化鈉、鐵、過氧化氫三種物質中,由離子構成是__________。
(2)下列微觀示意圖1中,能表示化合物的是_____(填字母序號,下同),能表示3個分子的是_______。
(3)A、B、C、D表示四種物質中,在高溫條件下,A和B反應生成C和D,微觀示意圖如圖2所示,反應后,生成C和D兩種粒子的個數比應為________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com