
【題目】人類的生產生活離不開金屬材料。
(1)人們習慣上把金、銀、銅、鐵、錫五種金屬統稱為“五金”,在“五金”順序中把一種金屬的位置移到最后,則正好符合某種化學規律。這種金屬和該化學規律分別是____________、___________。
(2)鋁、鐵、銅是我們生產生活中使用比較廣泛的金屬。以下用品中,主要利用金屬導熱性的是___________(填序號) 。
A銅導線
B不銹鋼高壓鍋
C鋁制易拉罐
(3)銅和鐵一樣也容易生銹,銅銹的主要成分是堿式碳酸鋼 (Cu2(OH)2CO3),是銅與空氣中的氧氣、水和_____________共同作用的結果。
【答案】鐵 金屬活動性順序 B CO2
【解析】
(1)金屬活動性順序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au,在金屬活動性順序里,金屬的位置越靠前,它的活動性就越強,故將鐵移到最后,金屬活動性正好從弱到強排列,故填:鐵、金屬活動性順序;
(2)A、銅導線利用了銅良好的導電性和延展性,不符合題意;
B、不銹鋼高壓鍋利用了金屬的導熱性,符合題意;
C、鋁制易拉罐利用了金屬良好的延展性,不符合題意。
故選B;
(3)根據質量守恒定律,化學反應前后,元素的種類不變,根據堿式碳酸銅的化學式:Cu2(OH)2CO3,堿式碳酸銅中含Cu、O、H、C四種元素,反應物有銅、氧氣、水,故還應含有碳元素,空氣中二氧化碳含有碳元素,故空氣中的二氧化碳參與了反應,故填:CO2。


 時刻準備著暑假作業原子能出版社系列答案
時刻準備著暑假作業原子能出版社系列答案 暑假銜接教材期末暑假預習武漢出版社系列答案
暑假銜接教材期末暑假預習武漢出版社系列答案 假期作業暑假成長樂園新疆青少年出版社系列答案
假期作業暑假成長樂園新疆青少年出版社系列答案科目:初中化學 來源: 題型:
【題目】用兩圓相切表示兩種物質可以發生反應,請回答下列問題:

(1)用兩個圓形表示C(氫氧化鉀溶液),D(硫酸銅溶液)兩種物質,請將C,D兩個圓畫到圖中A,B周圍適當的位置,并標出物質名稱。___
(2)寫出發生中和反應的化學方程式_______。
(3)寫出A,B反應的現象______。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】根據如圖所示實驗,Y 燒杯中溶液由紅色變為無色。
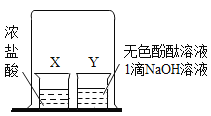
(1)該實驗可證明分子具有的性質是__________。
(2)請用化學方程式表示紅色變為無色的原因:_____________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】已知鋁在空氣中會生成一層致密的氧化膜(Al2O3),該氧化膜可與稀鹽酸發生反應: Al2O3+6HCl=2AlCl3+3H2O。實驗小組將未打磨的鋁片和稀鹽酸放入密閉容器中,用傳感器探究反應過程中溫度和壓強的變化,結果如下圖。下列說法正確的是()
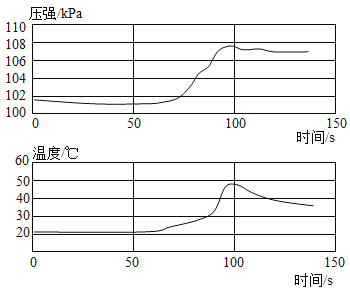
A.0~50 s,發生稀鹽酸與Al的反應
B.50 s時,溶液中溶質為AlCl3
C.50 s~100 s,壓強增大的原因是反應放熱
D.100s~140 s,壓強減小的原因是溫度降低
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】氯化鈣應用廣泛,以石灰石(雜質主要是Fe2O3、MgSO4)為原料生產氯化鈣的流程如下。
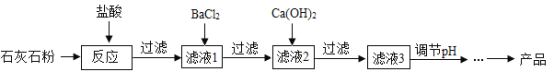
已知:BaCl2+MgSO4=BaSO4↓+MgCl2;Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2;Ca(OH)2+FeCl3=Fe(OH)3↓+CaCl2
(1)氧化鐵與鹽酸反應的化學方程式為______________________________。
(2)濾液1中的溶質有HCl、FeCl3、和_______。
(3)濾液2中加入Ca(OH)2是為了除去____(填序號,下同)
A MgCl2 B HClC BaCl2 D FeCl3
(4)為了生產較純凈的氯化鈣,濾液3呈堿性,為使溶液pH降低,可加入適量的_____。
A NaCl B NaOHC 硫酸 D 鹽酸
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】納米銅粉不僅可以作為催化劑直接應用于化工行業(如乙烯聚合),而且是高導電率、高強度納米材料不可缺少的基礎材料,其性質引起電子界的極大興趣。某研究性學習小組以廢黃銅絲(銅、鋅合金)為原料,制備納米銅粉,其流程如下:
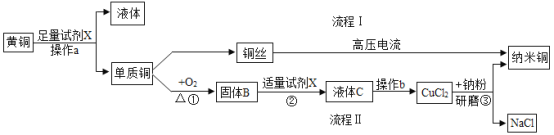
(1)試劑X的化學式為______________________,固體B的化學式為____________________。
(2)操作a所需的玻璃棒作用是___________________;操作b需用玻璃棒不斷攪拌,其作用是________________________。
(3)寫出反應②的化學方程式________________________;反應③屬于_____________反應(填反應類型);
(4)制備納米銅流程中,流程I是________________(填“物理”或“化學”)變化。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】甲、乙、丙三種固體物質的溶解度曲線如圖所示.下列敘述錯誤的是
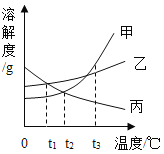
A.t1℃時,將等質量的甲、乙分別配成飽和溶液,所得溶液質量:甲>乙
B.將t1℃時甲、丙的飽和溶液升溫到t2℃,兩種溶液中溶質的質量分數相等
C.將t2℃時甲的飽和溶液變為t3℃時甲的飽和溶液,可以采用蒸發水的方法
D.將t3℃時三種物質的飽和溶液恒溫蒸發等量水后,析出溶質的質量:甲>乙>丙
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】同學們在整理實驗室時,發現一包白色粉末狀藥品,老師說該藥品由氯化鈉、碳酸鈣、氫氧化鈉中的兩種組成,同學們對此很好奇,于是對這包白色粉末的成分進行如下探究。
(作出猜想)猜想一:_______ 猜想二:CaCO3和NaOH 猜想三:NaCl和NaOH
(設計實驗)
實驗步驟 | 實驗現象 | 實驗結論 |
(1)取一定量白色粉末于燒杯中,加足量水,攪拌 | ________ | 猜想三不成立 |
(2)取少量(1)中所得溶液于試管中,向其中滴入氯化銅溶液 | ________ | 猜想二不成立 |
(3)另取少量(1)中所得溶液于試管中,向其中滴加過量的____溶液 | 產生白色沉淀 | 猜想一成立 |
寫出步驟(3)中發生反應的化學方程式____。
(拓展延伸)如何測定該白色粉末中碳酸鈣的質量分數呢?某同學利用碳酸鈣能與稀鹽酸反應產生二氧化碳來測定該白色粉末中碳酸鈣的質量分數,利用下列裝置測定二氧化碳的質量。
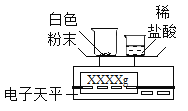
(1)將小燒杯中的所有稀鹽酸分幾次加入到大燒杯中并不斷攪拌,判斷白色粉末中碳酸鈣完全反應的實驗現象是_____。
(2)已知反應前的總質量[m(大燒杯+白色粉末)+m(小燒杯+稀鹽酸)],要計算生成CO2的質量,至少還需要的數據是____(填序號)。
A m(小燒杯) B m(大燒杯) C m(大燒杯+反應后剩余物)
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】無水溴化鈣可用作阻燃劑、制冷劑,具有易溶于水,易吸潮等性質。實驗室用工業大理石(含有少量Al3+、Fe3+等雜質)制備溴化鈣的主要流程如下:完成下列填空:
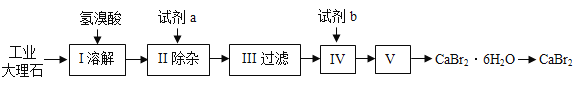
(1)上述使用的氫溴酸(HBr)的質量分數為26%,若用47%的氫溴酸配置26%的氫溴酸,所需的玻璃儀器有玻璃棒、燒杯、__________。
(2)已知步驟Ⅲ的濾液中不含NH4+。步驟Ⅱ加入的試劑a是_____,控制溶液的pH約為8.0,將Al3+、Fe3+分別轉化成沉淀而除去,寫出沉淀的化學式__________。
(3)試劑b的作用__________,寫出發生的化學反應方程式____________________。
(4)步驟Ⅴ所含的操作依次是_______________、降溫結晶、過濾。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com