
【題目】下表為氯化鈉和硝酸鉀的溶解度:
溫度 溶解度/g/100g水 物質 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 70℃ | 80℃ |
NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 |
(1)20℃時 KNO3 的溶解度_____(選填“大于”“小 于”)NaCl 的溶解度。隨著溫度升高,NaCl 的溶解度_____(選填“變大”“變小”或“不變”)。
(2)20℃時,完全溶解 18 g NaCl 恰好得到飽和溶液,所需水的質量是_____g,該溶液質量分數為_____。
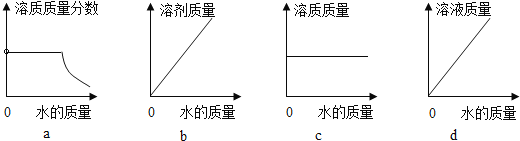
(3)20℃時,向 10 g KNO3 固體不斷加水,有關圖像正確的是_____(選填編號)。
(4)NaCl中含有少量KNO3提純NaCl采用的方法是_____(選填“蒸發結晶”或“降溫結晶”)。
(5)在最新爆發的 “新型肺炎”疫情的醫療上常用溶質質量分數為0.9%的生理鹽水為載體給患者輸液。某化學興趣小組欲配制500g溶質質量分數為0.9%的氯化鈉溶液。現有如下操作:①裝瓶、貼簽;②溶解氯化鈉;③秤取氯化鈉固體;④量取蒸餾水,正確的操作順序是_____;在量取水時,俯視刻度線會導致所配制溶液的溶質質量分數_____(填“偏大”、“偏小”或“無影響”)。
【答案】小于 變大 50 26.5% ab 蒸發結晶 ③④②① 偏大
【解析】
(1)由表可知,20℃時KNO3的溶解度為31.6g,氯化鈉的溶解度為36g,故20℃時KNO3的溶解度小于NaCl的溶解度;由表可知,隨著溫度升高,NaCl的溶解度變大;
(2)由表可知,20℃時,氯化鈉的溶解度為36g,即該溫度下,氯化鈉在100g水中達到飽和時,所溶解的質量為36g,故該溫度下,完全溶解18gNaCl恰好得到飽和溶液,所需水的質量是50g;該溶液的質量分數是:![]() ;
;
(3)a、20℃時,向 10 g KNO3 固體不斷加水,一開始,硝酸鉀未完全溶解,溶液為飽和溶液,溫度不變,飽和溶液的溶質質量分數不變,待硝酸鉀完全溶解后,隨著水的加入,溶質質量不變,溶液質量增大,溶質質量分數逐漸減小,符合題意;
b、20℃時,向 10 g KNO3 固體不斷加水,隨著水的加入,溶液中溶劑的質量不斷增大,符合題意;
c、20℃時,向 10 g KNO3 固體不斷加水,一開始,溶液中溶質的質量隨著硝酸鉀的溶解不斷增大,待硝酸鉀完全溶解后,溶質質量不再變化,不符合題意;
d、當硝酸鉀未完全溶解時,隨著水的加入,溶液質量逐漸增大,待硝酸鉀完全溶解后,隨著水的加入,溶液質量逐漸增大,但是增加幅度變小,不符合題意。故選ab;
(4)由表可知,氯化鈉、硝酸鉀的溶解度都隨溫度的升高逐漸增加,氯化鈉的溶解度受溫度影響較小,硝酸鉀的溶解度受溫度影響較大,故NaCl中含有少量KNO3提純NaCl采用的方法是:蒸發結晶;
(5)配制一定溶質質量分數的溶液的實驗步驟為:計算、稱量、量取、溶解、裝瓶,故正確的操作順序是:③④②①;
俯視讀數,讀取數值大于實際數值,會使量取水的質量偏小,從而導致溶液質量偏小,溶質質量不變,溶液質量偏小,故溶質質量分數偏大。


科目:初中化學 來源: 題型:
【題目】某同學利用下列裝置制取氧氣并驗證氧氣的性質。

(1)請寫出編號為①的儀器名稱______。
(2)實驗室用過氧化氫溶液制取氧氣可選用的發生裝置是______(填序號),發生反應的化學方程式為______。
(3)用裝置D收集氧氣的依據是______,用這種方法收集氧氣,驗滿的方法是______。
(4)在實驗室用B、F裝置制取氧氣,選用的試劑是______,發生反應的化學方程為______,試管口放棉花的作用為______,實驗前必須進行的操作是______,實驗結束時的操作是______。
(5)用坩堝鉗夾取一小塊木炭加熱到發紅后,插入到收集的氧氣中(具體操作是______),觀察到的現象是______。
(6)點燃系在光亮細鐵絲下的火柴,待______時,插入充滿氧氣的集氣瓶中,觀察到的現象是______,集氣瓶內預先放入少量水的目的是______,該反應的化學方程式為______。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】我國是全球最大的純堿生產大國,純堿產量多年來一直穩居世界首位。“十三五”期間純堿行業以節能減排為著力點,推進產業轉型升級。氨堿法制堿用于實驗制備純堿的部分簡單流程如下圖所示。
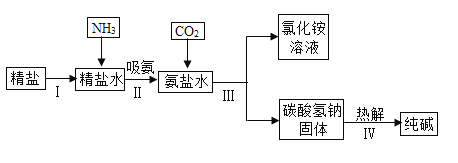
(1)氨氣極易溶于水,向飽和食鹽水通入氨氣可得到飽和食鹽水和氨水的混合鹽水(稱為氨鹽水)。請分析氨鹽水比食鹽水更容易吸收二氧化碳的原因是_______;
(2)氨鹽水吸收二氧化碳后生成碳酸氫鈉和氯化銨,首先析出物質的是___________,其原因是___________;
(3)請分別寫出步驟Ⅲ、步驟Ⅳ反應的化學方程式為______、_____。其中副產品氯化銨是一種____(選填“氮”、“磷”、“鉀”或“復合”)肥。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】仔細閱讀下面的探究實驗信息,回答相關問題。
I.[實驗目的]探究溶解過程中,溶液溫度的變化情況。
II.[查閱資料]
(1)物質溶解于水的過程包括吸收熱量(Q吸)的擴散過程和放出熱量(Q放)的水合過程。
(2)實驗條件下,水的凝固點為0℃、沸點為100℃。
III.[提出猜想]物質溶解過程中,溶液的溫度可能升高或降低或不變。

IV.[實驗探究]某探究小組的同學設計了如下圖所示的兩種實驗方案。在圖2所示方案中,每次加入物質b之前,均使用溫度計控制熱水溫度,使之保持在99℃。
V.[實驗結論]
(1)圖1所示實驗中,若加入物質a后,發現玻璃片與燒杯底部之間的水結冰,說明溶液的溫度_____(填“升高”或“降低”或“不變”,下同)。
(2)圖2所示實驗中,若加入物質b后,熱水會突然沸騰,說明溶液的溫度__________。
VI.[拓展實驗]按照圖3所示進行實驗。若物質c為NaOH,則U型管內的左邊液面將_______(填“升高”或“低于”或“等于”)右邊液面;若U型管內的液面位置變化與之相反,則物質c為______(填序號)。

①CaO ②NH4NO3 ③濃H2SO4
VII.[反思交流]
(1)該小組的同學進一步就物質溶解過程中溶液溫度變化的原因展開了討論,分析得出:若Q吸_____Q放(填“>”或“<”或“=”,下同),則溶液溫度升高;若Q吸與Q放的相對大小與之相反,則溶液溫度降低;若Q吸_____Q放,則溶液溫度不變。
(2)在圖2所示方案中,小張同學對實驗現象很感興趣,他繼續向熱水中加入相同質量的物質b,又看到沸騰現象,至燒杯中出現固體物質后,再繼續加入相同質量的物質b,就看不到沸騰現象。請解釋不再產生沸騰現象的原因________________________________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】A、B、C三種物質的溶解度曲線如圖所示。下列分析正確的是

A. 三種物質的溶解度:A>B>C
B. t2℃時,把50gA放入50g水中能得到A的飽和溶液,其中溶質和溶液的質量比為1:2
C. 將t2℃時,A、B兩種物質的飽和溶液分別降溫至t1℃,所得溶液的溶質質量分數的大小關系是B>A
D. 將C的飽和溶液變為不飽和溶液,可采用升溫的方法
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】用化學用語填空:
(1)2個氧原子______;
(2)鐵離子______;
(3)保持水的化學性質的最小粒子_________;
(4)高錳酸鉀中錳元素的化合價______。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】我國國家發改委等七部委聯合發布公告稱,2019年1月1日起,全國全面供應符合第六階段強制性國家標準VIA車用汽、柴油,即油品中硫含量要求不大于0.001%(10ppm)。
(1)目前,多數燃油汽車使用的燃料是汽油或柴油。我國大中城市所有機動車都要進行尾氣檢測,其中包括PM2.5的檢測。汽柴油燃燒產生的顆粒物主要是____,這是汽柴油________(填“完全”或“不完全”)燃燒產生的。
(2)我國“國六”汽柴油標準屬世界最高質量標準,油品硫含量指標限值為每千克10毫克,硫是危害汽車催化器的最大殺手,升級成品油質量降低其含硫量,對治理空氣污染的好處在于(至少一點)___________。
(3)我國“國六”標準的氮氧化物降低了42%。使用催化凈化裝置,采用鉑鈀合金作催化劑,將汽車尾氣中CO和NO發生反應,生成兩種參與大氣循環的無毒氣體,該反應的化學方程式為___________。
(4)2019年1月1日起,我國全面供應國六標準汽柴油,請從資源、環境兩方面說明,提出治理汽車污染的合理化建議:___________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】金屬鎢(W)可做白熾燈泡的燈絲。用黑鎢礦(主要含 FeWO4)制得金屬鎢的工藝流程如下圖所示:
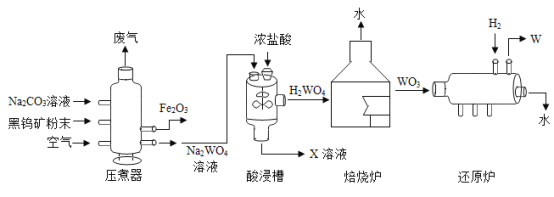
(1)將黑鎢礦石碾成粉末,目的是_________。
(2)酸浸槽中,發生了復分解反應,化學方程式為_________。
(3)還原爐中,反應前后,元素化合價降低的元素是_________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】我國推廣使用乙醇汽油,到2020年在全國范圍內基本實現車用乙醇汽油全覆蓋。根據乙醇的化學式C2H5OH,通過計算回答:
(1)乙醇的相對分子質量為______。每個分子中共有____個原子。
(2)乙醇中碳、氫元素的原子個數比為______(填最簡整數比)。
(3)乙醇中碳、氫和氧四種元素的質量比為______。
(4)乙醇中氫元素的質量分數為_______(計算結果精確到0.01%)。
(5)92g乙醇中含有氧元素的質量為_____g。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com