
【題目】化學興趣小組對某工業廢水(含有H2SO4、Na2SO4)中H2SO4的含量進行測定.甲、乙兩同學各提出不同的測定方法,請回答有關問題:
(1)甲同學:取50g廢水于燒杯中,逐漸滴入溶質質量分數為20%的NaOH溶液,反應過程溶液pH變化如圖. 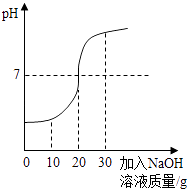
①50g廢水中H2SO4的質量是多少?寫出計算過程 .
②當加入30g NaOH溶液時,燒杯中的溶質為(填化學式).
(2)乙同學:改用BaCl2溶液代替NaOH溶液測定廢水中的H2SO4的含量,結果可能會(填“偏高”、“偏低”、“不變”),理由是 .
【答案】
(1)解:①設廢水中硫酸的質量為x
H2SO4+ | 2NaOH═Na2SO4+2H2O |
98 | 80 |
x | 20g×20% |
?? ![]()
解得:x=4.9g????????????
答:廢水中硫酸的質量為4.9g;Na2SO4、NaOH
(2)偏高;BaCl2溶液也會與廢水中的Na2SO4反應
【解析】(2)當加入30g NaOH溶液,溶液的pH值大于7,說明氫氧化鈉溶液過量,所以當加入30g NaOH溶液時,燒杯中的溶質為Na2SO4、NaOH;故填:Na2SO4、NaOH;(3)氯化鋇溶液可以和硫酸反應生成硫酸鋇沉淀,也可以和硫酸鈉溶液反應生成硫酸鋇沉淀,所以會導致測定結果偏高. 故答案為:偏高;BaCl2溶液也會與廢水中的Na2SO4反應.
(1)硫酸可以和氫氧化鈉發生中和反應,它們恰好完全反應時溶液呈中性,分析圖象可以知道恰好完全反應時消耗氫氧化鈉溶液的質量為20g,可以據此結合反應的化學方程式可以計算出廢水中硫酸的質量;(2)根據當加入30g NaOH溶液,溶液的pH值大于7,說明氫氧化鈉溶液過量進行解答;(3)氯化鋇溶液可以和硫酸反應生成硫酸鋇沉淀,也可以和硫酸鈉溶液反應生成硫酸鋇沉淀,可以據此進行分析并完成解答.


 暑假銜接培優教材浙江工商大學出版社系列答案
暑假銜接培優教材浙江工商大學出版社系列答案 欣語文化快樂暑假沈陽出版社系列答案
欣語文化快樂暑假沈陽出版社系列答案科目:初中化學 來源: 題型:
【題目】將二氧化碳中混入的一氧化碳除去,得到較純凈的二氧化碳,應采用的方法是 ( )
A. 將混合氣體通過加熱的氧化銅
B. 將混合氣體點燃,使一氧化碳充分燃燒
C. 將混合氣體通過澄清的石灰水
D. 將集氣瓶口朝上,移開玻璃片使一氧化碳氣體逸出
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】黃銅礦(主要成分 CuFeS2)經初步處理后,所得溶液中的溶質為Fe2(SO4)3、CuSO4及 H2SO4 . 某同學通過廢鐵屑與所得溶液反應,制取還原鐵粉并回收銅. 主要步驟如圖所示: 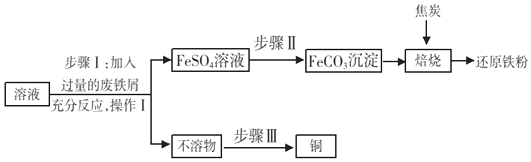
(1)Fe2(SO4)3與鐵反應的化學方程式:x Fe2(SO4)3+y Fe═z FeSO4 , 其中 x、y、z 為化學計量數,z 的值為 .
(2)操作Ⅰ的名稱是 , 此操作中起到引流作用的儀器是 .
(3)步驟Ⅰ中,生成銅的化學方程式: .
(4)步驟Ⅰ中,廢鐵屑含有少量鐵銹,對產物的成分沒有影響,原因是 .
(5)步驟Ⅱ中加入一種可溶性試劑可實現其轉化,從復分解反應發生的條件分析,該試劑可以是(填化學式).
(6)隔絕空氣進行“焙燒”,鐵元素的轉化途徑是FeCO3 ![]() FeO
FeO ![]() Fe, 實際作還原劑的是 CO. 寫出“焙燒”過程中各步反應的化學方程式:
Fe, 實際作還原劑的是 CO. 寫出“焙燒”過程中各步反應的化學方程式:
①FeCO3 ![]() FeO+CO2↑
FeO+CO2↑
②.
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某研究小組成功制備了四氧化銥陽離子(IrO4+),已知其中氧元素化合價為-2價,由此判斷銥元素的化合價為
A. +9 B. +7 C. +5 D. +3
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某校化學興趣小組對雪碧中的氣體進行了如下探究,請你回答下列問題: 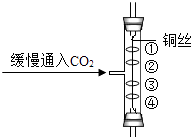
(1)猜想:雪碧中的氣體是二氧化碳
用注射器抽取一定的雪碧,上下振蕩,然后將液體部分擠出,收集到一注射器的氣體,問:怎樣設計實驗證明其為二氧化碳: , 該反應的化學方程式為: .
(2)對二氧化碳性質的探究
收集一注射器的CO2 , 然后將該氣體緩慢的通過如圖所示的裝置后(圖中①、④為用紫色石蕊溶液潤濕的棉球,②、③為用紫色石蕊溶液染成紫色的干燥棉球),發現:
①棉球2和3均不變紅,這是因為: .
②棉球4比1先變紅,說明: .
③棉球1也變紅的原因是: .
(3)該小組還注意到:打開雪碧瓶后,立即能觀察到有大量氣泡產生,這說明二氧化碳在水中溶解的多少與因素有關.
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】甲、乙兩種物質的溶解度曲線如圖6所示.下列說法正確的是( )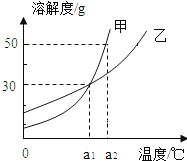
A.a1℃時甲和乙的飽和溶液,升溫到a2℃時仍是飽和溶液
B.甲和乙的溶解度相等
C.a1℃時,甲和乙各30g分別加入100g水中,均形成飽和溶液
D.a2℃時,在100g水中加入60g甲,形成不飽和溶液
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com