
【題目】現有 H2SO4 與 CuSO4 的混合溶液,為了分析混合溶液中 H2SO4與 CuSO4 的質量分數,設計了如圖 1 實驗方案:
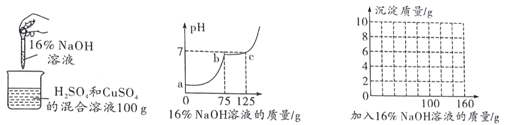
圖1 圖2
(1)根據圖 1 坐標,推測 CuSO4 溶液呈________(填“酸”、“堿”、“中”) 性;C 點溶液中的溶質為_______(寫化學式)。
(2)請計算該混合溶液中的CuSO4 的溶質質量分數_________。
(3)若在100g 混合溶液中不斷加入上述氫氧化鈉溶液,請你在圖 2 中畫出加入氫氧化鈉溶液的質量與產生沉淀的質量的關系圖________。
(4)根據該方案的實驗現象就能證明硫酸和氫氧化鈉發生了中和反應的原因是____。
【答案】酸 Na2SO4 16% 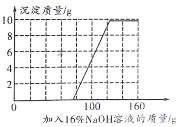 往H2SO4與CuSO4 的混合溶液中加入加入NaOH溶液時,開始并沒有產生白色沉淀,說明開始加入的NaOH沒有與CuSO4反應,由此可知,NaOH能與H2SO4反應。
往H2SO4與CuSO4 的混合溶液中加入加入NaOH溶液時,開始并沒有產生白色沉淀,說明開始加入的NaOH沒有與CuSO4反應,由此可知,NaOH能與H2SO4反應。
【解析】
(1)根據圖 1 坐標可知,加入氫氧化鈉溶液之前溶液的pH<7,故可推測CuSO4 溶液呈酸性;![]() ,C 點溶液的pH=7,則反應是恰好反應,故C 點溶液中的溶質為Na2SO4。
,C 點溶液的pH=7,則反應是恰好反應,故C 點溶液中的溶質為Na2SO4。
(2)設100g混合溶液中的CuSO4 的質量為x,反應生成Cu(OH)2的質量為y。
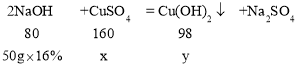
![]() ,解得x=16g
,解得x=16g
![]() ,解得y=9.8g
,解得y=9.8g
混合溶液中硫酸銅的質量分數為:![]() =16%
=16%
(3)由圖 1 坐標可知,開始加入的75gNaOH溶液與H2SO4反應,從75g開始生成沉淀,生成沉淀的質量最多是9.8g,所以圖像是:

(4)往H2SO4與CuSO4 的混合溶液中加入加入NaOH溶液時,開始并沒有產生白色沉淀,說明開始加入的NaOH沒有與CuSO4反應,由此可知,NaOH能與H2SO4反應。


科目:初中化學 來源: 題型:
【題目】如圖中A~H是初中化學常見的物質。A俗稱蘇打;C可用作補鈣劑;G是一種常見的氮肥,含氮量為35%;H、F物質類別相同。圖中“-”表示兩端的物質間能發生化學反應;“→”表示物質間存在轉化關系;反應條件、部分反應物和生成物已略去。
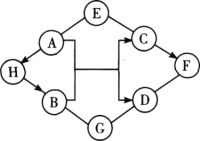
(1)寫出化學式:A________,G________,D________。
(2)寫出H轉化為B的反應化學方程式:________。
(3)若E與G的組成元素相同,則E的名稱為________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】已知草酸晶體(H2C2O43H2O)在濃硫酸作用下受熱分解,化學方程式為: H2C2O43H2O  CO2 ↑ + CO ↑ + 4H2O。工業鐵紅的主要成分是Fe2O3,還含有少量的FeO、Fe3O4。某化學興趣小組的同學利用草酸晶體制備一氧化碳,通過如下裝置測定鐵紅中鐵元素的質量分數。(裝置氣密性良好,試劑均足量。)
CO2 ↑ + CO ↑ + 4H2O。工業鐵紅的主要成分是Fe2O3,還含有少量的FeO、Fe3O4。某化學興趣小組的同學利用草酸晶體制備一氧化碳,通過如下裝置測定鐵紅中鐵元素的質量分數。(裝置氣密性良好,試劑均足量。)
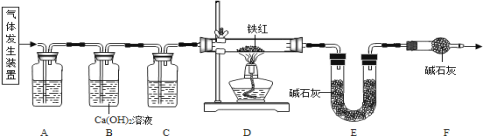
(1)下列可用作草酸分解制取氣體的裝置是__________(填字母編號)

(2)寫出D裝置中一氧化碳還原氧化鐵的化學方程式____________。
(3)稱取質量為m的鐵紅樣品,用上述裝置進行實驗,測定鐵紅中鐵的質量分數。
①反應結束后D中得到Fe粉的質量x,則x的取值范圍為____________(用m的代數式表示)。
②若充分反應后,稱得E裝置增重n,則此鐵紅中鐵的質量分數是_________(用m、n的代數式表示)。
(4)關于該實驗,下列說法正確的是_____________。
①進入D中的氣體是純凈、干燥的CO,則A、C中的試劑分別是濃硫酸和澄清石灰水
②對D裝置加熱前和停止加熱后,都要通入過量的CO,其作用都是防止爆炸
③裝置F的作用是防止空氣中的二氧化碳和水蒸氣進入到裝置E中
④實驗裝置有一明顯的缺陷是沒有尾氣處理裝置
⑤若沒有裝置C,則測定的鐵元素的質量分數會偏大
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】維生素C泡騰片深受廣大消費者喜愛。小林同學查閱了相關資料,了解到泡騰片產生氣泡的原因是發生了反應:3NaHCO3+C6H8O7=Na3C6H5O7+3CO2↑+3H2O。他為了測定泡騰片中NaHCO3的質量,進行了如下實驗:稱量加入水后的飲料瓶及瓶蓋中的5片樣品的總質量(如圖),記錄數據為448.50g。將樣品加入水中,搖動至無氣泡產生,再次稱重飲料瓶及瓶蓋,記錄數據為446.30g。請計算:

(1)生成的CO2的質量為_____。(假設生成的CO2全部逸出)
(2)每片泡騰片中碳酸氫鈉的質量。_____(假設泡騰片中的NaHCO3全部參與反應。寫出計算過程及結果)
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】中國是全球抗生素濫用最嚴重的國家之一,需引起我們重視。 環丙沙星是常用的一種抗生素,其說明書中部分內容如圖。

(1)環丙沙星屬于____(填“有機”或“無機”)化合物。
(2)環丙沙星分子中碳、氫、氧的原子個數比為____。
(3)環丙沙星中氟元素的質量分數為____(結果精確到 0.1%)。
(4)患者一個療程共服用了____片環丙沙星片。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】在人們擔心化石能源將被耗盡時,科學家發現海底埋藏著大量可以燃燒的“冰”﹣﹣“可燃冰”。可燃冰外觀像冰,主要含有甲烷水合物(由甲烷分子和水分子組成),還含少量二氧化碳等氣體。可燃冰在低溫和高壓條件下形成。1體積可燃冰可儲載100~200倍體積的甲烷氣體,具有能量高,燃燒值大等優點。可燃冰將成為未來新能源。目前,我國在可燃冰的開采技術上處于世界領先水平。回答下列問題:
(1)可燃冰屬于_____(填字母序號) A 純凈物 B 混合物
(2)甲烷在空氣中完全燃燒的化學方程式為_____。
(3)甲烷中氫為+l價,碳為_____價。
(4)從環境保護的角度考慮,下列燃料中最理想的是_____。 (填字母序號)
A 氫氣 B 可燃冰 C 酒精 D 汽油
(5)可燃冰作為未來新能源,與煤、石油相比其優點是_____。(答一點即可)
(6)可燃冰在海底不燃燒的原因是_____;
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】實驗室常用的氣體發生裝置如圖一所示。
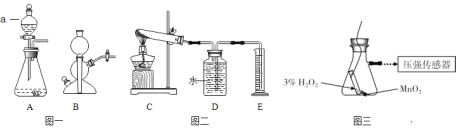
(1)儀器a的名稱___;
(2)含溶質6.8g的過氧化氫溶液完全分解,可以生成___克氧氣;
(3)用5%的過氧化氫溶液和二氧化錳為原料制取氧氣,較合理的發生裝置是______(選填裝置編號);
(4)加熱氯酸鉀和二氧化錳的混合物一段時間,測定生成氧氣的體積,用圖二所示裝置進行實驗(裝置氣密性良好)。試管中發生反應的化學方程式是__;有關該實驗的說法合理的是__(選填編號);
a.實驗開始前裝置D中必須裝滿水
b.先連接C、D、E裝置后點燃酒精燈
c.停止加熱后,量筒內液面會下降
d.停止加熱前應斷開C、D 裝置,防止液體倒流
(5)某老師設計圖三裝置探究二氧化錳的質量對過氧化氫溶液分解反應的影響。
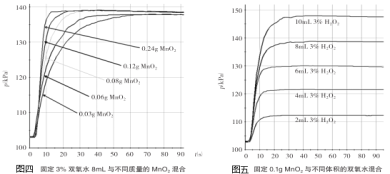
探究Ⅰ.每次固定取用雙氧水溶液(3%)8mL分別與不同質量的二氧化錳混合,記錄容器內壓強的變化于圖四中。當二氧化錳的用量增加到0.08g后,曲線的斜率(即表征催化反應的速率)基本上就一致了。因此能快速催化的二氧化錳的最小用量與過氧化氫的質量比約為___(雙氧水溶液的密度近似為1g/mL),二氧化錳的質量很小時,反應速率慢的原因是___。
探究Ⅱ.每次固定取用0.1g二氧化錳分別和不同體積的3%的雙氧水溶液混合,記錄容器內壓強的變化于圖五中,當雙氧水溶液的體積由2mL增加到___mL時,與探究Ⅰ中反應速率相近。該實驗說明生成氧氣的質量與___的質量成正比。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】過氧化鈣(CaO2)是一種對環境友好的多功能無機化合物,通常有兩種制備方法。
已知:溫度過高過氧化物會分解生成氧化物和氧氣。
方法1:由Ca(OH)2為原料最終反應制得,其制備流程如下圖:
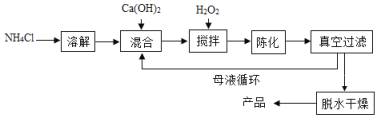
方法2:由雞蛋殼(含CaCO3高達90%)為原料最終反應制得,其制備流程如下圖:
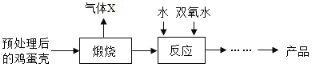
(1)方法1中攪拌的目的是_____________。請將攪拌過程中發生反應的化學方程式補充完整:CaCl2+H2O2+2NH3H2O+6________=CaO28H2O↓+2NH4Cl,反應完全后過濾、洗滌,若要檢驗沉淀是否洗滌干浄,可向最后一次洗滌液中加___________。方法1制備過程中除水外可循環使用的物質是________________________(填化學式)。
(2)方法2中煅燒后的反應是化合反應,也能生成CaO28H2O,反應的化學方程式為_____________。該反應需控制溫度在0~2℃,可將反應器放置在_____________中,獲得的CaO2產品中主要含有的固體雜質是___________(填化學式)。
(3)這兩種制法均要求在低溫下進行(除煅燒外),溫度不宜過高除了防止氨水揮發外,還能______________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】閱讀下面科普短文:![]() 身輕頑皮的鋰
身輕頑皮的鋰![]()
鋰是一種活潑金屬,它質地很軟,可以用小刀輕輕切開,新切開的鋰有銀白色的金屬光澤,別看它的模樣跟有些金屬差不多,性格特點可不同一般哩![]() 首先它特別的輕,是所有金屬中最輕的一個。其次它生性活潑,愛與其他物質結交。它是唯一的與氮氣在室溫下反應,生成氮化鋰
首先它特別的輕,是所有金屬中最輕的一個。其次它生性活潑,愛與其他物質結交。它是唯一的與氮氣在室溫下反應,生成氮化鋰![]() 的堿金屬。遇水反應生成氫氧化鋰
的堿金屬。遇水反應生成氫氧化鋰![]() 化學式
化學式![]() 和一種可燃性氣體。氫氧化鋰是一種易溶于水的白色固體,有辣味;化學性質與NaOH相似,溶于水后所得溶液能使無色酚酞試液變紅,有腐蝕性。顯然,對于這樣如此活潑的金屬鋰,要保存它是十分困難的,它不論是在水里,還是在煤油里,都會浮上來燃燒。化學家們最后只好把它強行捺入凡士林油或液體石蠟中,把它的野性禁錮起來,不許它惹事生非。鋰在自然界中存在的主要形式為鋰輝石,鋰云母等,我國江西有豐富的鋰云母礦。目前,世界上多數采用電解熔化氯化鋰的方法制得金屬鋰。
和一種可燃性氣體。氫氧化鋰是一種易溶于水的白色固體,有辣味;化學性質與NaOH相似,溶于水后所得溶液能使無色酚酞試液變紅,有腐蝕性。顯然,對于這樣如此活潑的金屬鋰,要保存它是十分困難的,它不論是在水里,還是在煤油里,都會浮上來燃燒。化學家們最后只好把它強行捺入凡士林油或液體石蠟中,把它的野性禁錮起來,不許它惹事生非。鋰在自然界中存在的主要形式為鋰輝石,鋰云母等,我國江西有豐富的鋰云母礦。目前,世界上多數采用電解熔化氯化鋰的方法制得金屬鋰。
金屬鋰的應用非常廣泛,它主要作為抗痛風藥服務于醫學界。直到20世紀初,鋰才開始步入工業界,嶄露頭角。如鋰與鎂組成的合金,能像點水的蜻蜓那樣浮在水上,既不會在空氣中失去光澤,又不會沉入水中,成為航空,航海工業的寵兒。此外,鋰還在尖端技術方面大顯身手。例如,氘化鋰是一種價廉物美的核反應堆燃料;固體火箭燃料中含有![]() 的鋰。
的鋰。
![]() 本文介紹了金屬鋰的結構、性質和_________等方面。
本文介紹了金屬鋰的結構、性質和_________等方面。
![]() 在鋰原子結構中,與鋰元素化學性質密切相關的是_____________。
在鋰原子結構中,與鋰元素化學性質密切相關的是_____________。
A 質子數 B 中子數 C ![]() 核電荷數 D 最外層電子數
核電荷數 D 最外層電子數
![]() 金屬鋰具有的物理性質有________________________________________。
金屬鋰具有的物理性質有________________________________________。![]() 至少寫三點
至少寫三點![]()
![]() 金屬鋰 ________
金屬鋰 ________![]() 填“能”或“不能”
填“能”或“不能”![]() 保存在煤油中。
保存在煤油中。
![]() 載人航天飛船中常用LiOH代替NaOH用來吸收航天員呼吸產生
載人航天飛船中常用LiOH代替NaOH用來吸收航天員呼吸產生![]() ,則LiOH與
,則LiOH與![]() 反應的化學方程式為________________________。
反應的化學方程式為________________________。![]() 友情提示:
友情提示:![]() )
)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com