
【題目】溶解是生活中常見的現象,不同物質在水中的溶解能力不同。下表是KNO3、NaCl在不同溫度下的溶解度(單位:g/100g水)。
溫度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
(1)上表中的兩種物質在40℃時,_______(填化學式)的溶解度較大。
(2)請寫出一種將KNO3的不飽和溶液轉化為飽和溶液的方法____________________。
(3)20℃時,將20gNaCl放入50g水中,所得溶液的質量是______g。
(4)從NaCl溶液中得到NaCl晶體的方法是________。
(5)請用表格中的數據計算20℃時,NaCl飽和溶液的質量分數_________。
【答案】KNO3 增加KNO3(或降低溫度或蒸發溶劑) 68 蒸發結晶 26.5%
【解析】
(1)由上表可看出,上表中的兩種物質在40℃時,KNO3的溶解度較大。
(2)由于KNO3的溶解度隨溫度的升高而增大,將KNO3的不飽和溶液轉化為飽和溶液的方法有降低溫度(或增加KNO3或蒸發溶劑)。
(3)20℃時,NaCl的溶解度是36.0g,則50g水中最多能溶解18gNaCl,故將20gNaCl放入50g水中,所得溶液的質量是50g+18g=68g。
(4)NaCl的溶解度受溫度變化影響不大,故從NaCl溶液中得到NaCl晶體的方法是蒸發結晶。
(5)20℃時,NaCl的溶解度是36.0g,則20℃時,NaCl飽和溶液的質量分數為:![]() ≈26.5%
≈26.5%


 一線名師權威作業本系列答案
一線名師權威作業本系列答案科目:初中化學 來源: 題型:
【題目】歸納推理是提高學習效率的常用方法,下列有關歸納與推理完全正確的是( )
A. 純凈物是由一種物質組成的,則空氣是一種純凈物
B. 復分解反應有沉淀、氣體或水生成,則有沉淀、氣體或水生成的反應都是復分解反應
C. 鋁比鐵活潑,所以通常情況下鐵的抗腐蝕性能比鋁強
D. 進行得很慢的氧化反應叫緩慢氧化,則食物腐爛是緩慢氧化
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下列實驗設計能夠實現其對應實驗目的的是
A. 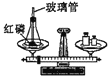 驗證質量守恒定律
驗證質量守恒定律
B. 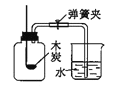 測定空氣中氧氣的含量
測定空氣中氧氣的含量
C. 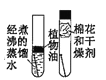 探究鐵釘銹蝕的條件
探究鐵釘銹蝕的條件
D. 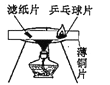 探究燃燒的條件之一:溫度達到著火點
探究燃燒的條件之一:溫度達到著火點
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】如圖是實驗室制取氣體并進行有關實驗的裝置圖,請回答問題:

(1)圖中標識①儀器的名稱是____;
(2)實驗室用裝置A制取氧氣的化學方程式____,實驗室既可以制取CO2,又可以制取O2的發生和收集裝置組合為____(在A~E中選),實驗室制取CO2的化學方程式為____;
(3)若用F裝置收集一瓶干燥的某氣體,則該氣體可能是____(填字母代號)
A.NH3 B.H2 C.O2
(4)2018年4月11日,疑似圓明園文物、西周晚期的“青銅虎鎣(yíng)”在英國坎特伯雷拍賣行拍賣,其表面呈綠色,小明查閱資料得知,這是銅器長期暴露在空氣中生成了銅綠,主要成分為Cu2(OH)2CO3。

①根據銅綠的成分,你認為銅綠的形成是銅與水、氧氣和____共同作用的結果;
②為探究銅綠的組成中是否含有碳元素,小明同學從其它銅器上取下適量的銅綠,可利用裝置A和____(填序號)相連進行實驗,若觀察到____,則證明銅綠的組成中含有碳元素;實驗結束時,應先___(填序號,A.移出導管;B.熄滅酒精燈)。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】在化學興趣小組活動中,老師為大家變了一個“水生火”的魔術:在兩片蓬松的脫脂棉中間包夾一些淡黃色固體粉末,做成“夾心餅干”。用膠頭滴管向“夾心餅干”上滴水。數滴后“夾心餅干”燃燒起來。經老師介紹,該淡黃色固體為過氧化鈉(Na2O2),能與水反應生成一種常見可溶性固體化合物X和一種常見氣體Y。
(提出問題)化合物X和氣體Y分別是什么?
(作出猜想)同學們認為X應為NaOH,但對Y的成分產生了分歧,猜想:①O2;②H2;③CO2;
經討論,猜想_____(填序號)肯定不合理,理由是_____。
老師指導:同一化學反應中,若有元素化合價降低,必有元素化合價升高。Na2O2中O元素顯—1價。
結合以上規律,你認為氣體Y的化學式為_____。
(實驗驗證)
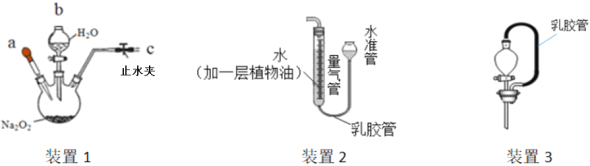
實驗步驟 | 實驗現象 | 實驗結論 |
① _____,向分液漏斗中加水,打開 分液漏斗活塞 | 分液漏斗中有一段穩定的水柱 | 裝置1氣密性良好 |
②取少量Na2O2于三頸燒瓶中,打開止水夾,加入適量水 | 固體溶解,形成無色溶液,有氣泡產生 | |
③從a處滴管滴加CuSO4溶液 | _____ | X為NaOH |
寫出Na2O2與H2O反應的化學方程式_____;
(發現問題)Na2O2固體敞口放置一段時間后,有細心的同學發現其中含有少量白色粉末。
(查閱資料)Na2O2在空氣中可以和CO2反應而變質,生成Na2CO3和O2。
(定量探究)測定該Na2O2樣品中Na2CO3的質量分數。
①取5.0g該樣品于裝置1中,加水配成溶液,冷卻至室溫;
②將裝置2與裝置1連接;將b處分液漏斗替換為裝置3(內盛稀硫酸);
③上下調節裝置2的水準管至左右兩管液面相平,記錄左管中液面讀數為20.0mL;
④用裝置3向溶液中滴加稀硫酸至_____(填實驗現象);
⑤再次上下調節裝置2的水準管至左右兩管液面相平;
⑥記錄左管中液面讀數為80.0mL;
已知CO2在該實驗環境下的密度約為1.8×10-3g/mL,根據實驗數據計算:
(1)生成CO2的質量為_____g(計算結果精確到0.01);
(2)該Na2O2樣品中Na2CO3的質量分數(寫出計算過程)_____;
(實驗分析)用裝置3替換分液漏斗的優點是_____;
(魔術揭秘)“水生火”的原理:
①脫脂棉具有可燃性;②脫脂棉與O2接觸;③從能量變化的角度Na2O2與H2O的反應是_____反應。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】同學們發現新鮮的蘋果汁在空氣中放置一段時間后會變色,仿佛鐵生銹一樣。于是,研究性小組同學設計并進行實驗,探究蘋果汁變色的原因。
(查閱資料)
a.蘋果汁中含有0.001%的二價鐵物質,同時也含有多酚類物質,多酚可與空氣中的氧氣反應變為褐色。
b.二價鐵在空氣中或與濃硝酸反應都能變為三價鐵,且三價鐵的溶液為黃色
c.硫氰化鉀(KSCN)溶液變色規律
藥品 | 二價鐵溶液 | 三價鐵溶液 |
KSCN溶液 | 不變色 | 變紅色 |
(猜想與假設)
Ⅰ.蘋果汁變色與蘋果中的鐵元素有關
Ⅱ.蘋果汁變色是蘋果汁中的多酚物質與空氣中的氧氣反應的結果
(進行實驗)
編號 | 實驗操作 | 實驗現象 | |||
實驗1 |
| 試管②中未出現明顯變化 試管③中…… | |||
實驗2 | 分別放置于空氣中一段時間 (如下圖所示)
| 試管編號 | 1min | 10min | 24小時 |
① | 黃褐色 | 褐色 | 深褐色 | ||
② | 無明顯變化 | 無明顯變化 | 無明顯變化 | ||
③ | 略有些黃色 | 淺黃 | 黃色 | ||
實驗3 | …… | 蘋果汁不變色 | |||
(解釋與結論)
(1)實驗1驗證了蘋果汁中含有二價鐵物質。在該實驗中③的現象是_____。
(2)實驗2的②中FeSO4溶液溶質的質量分數為_____%。該實驗中,試管②③實驗對比得出的結論是_____。由實驗2得出:猜想Ⅰ_____(填“成立”或“不成立”)。
(3)為驗證猜想II成立,實驗3應進行的操作_____。
(反思與評價)
(4)寫出一種防止蘋果汁變色的方法_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】(5分)甲、乙、丙三種固體物質在水中的溶解度曲線如圖所示。請回答:

(1)圖中P點的意義是
(2)若甲中混有少量的乙,最好采用 的方法提純甲
(3)使30℃接近飽和的甲溶液變成該溫度下的飽和溶液,可采用的 一種方法是
(4)使50℃甲、乙、丙三種物質的飽和溶液降溫到10℃,則其溶質質量分數不變的是
(5)向100g 50℃的水中加入65g甲固體,發現全部溶解,一段時間后又有部分甲的晶體析出。你認為“全部溶解”的原因可能是
查看答案和解析>>
科目:初中化學 來源: 題型:
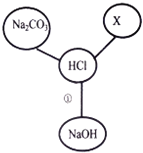
【題目】小紅同學在學習鹽酸的化學性質時,歸納出了鹽酸與其它物質相互反應的關系,如圖(圖中“﹣”表示相連的兩種物質能發生反應).
(1)若X是與其它三種不同類別的化合物,則X可以是 (填化學式,只填一種即可).
(2)根據如圖所示物質間的關系,寫出①反應的化學方程式: .
(3)當X是單質時,請寫出X與稀鹽酸反應的化學方程式: (只寫出一個即可).
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】甲、乙、丙三種固體物質的溶解度曲線如下圖所示。據圖回答問題:
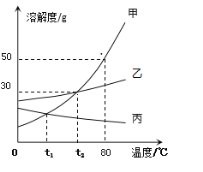
(1)80℃時,甲物質的溶解度是__________。
(2)欲將t1℃甲物質的不飽和溶液變為該溫度下的飽和溶液,可采取的方法:_____(任填一種)。
(3)t2℃時,把甲、乙、丙三種物質的飽和溶液降溫到t1℃,溶質質量分數不變的是______。
(4)若要讓乙物質從它的飽和溶液中全部結晶析出,應采取的方法是__________。
(5)在80℃時,將150克甲物質的飽和溶液稀釋成質量分數為20%的溶液需加水____ 克。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com