
【題目】下列觀點都是錯誤的,請你用化學方程式加以說明:
觀點 | 化學方程式 |
①氧化反應一定是化合反應 | _____ |
②有鹽和水生成反應一定是中和反應 | _____ |
③置換反應一定有金屬生成 | _____ |
④堿和鹽反應不可能同時產生兩種沉淀 | _____ |
【答案】CH4+2O2![]() CO2+2H2O CO2+2NaOH═Na2CO3+H2O C+H2O
CO2+2H2O CO2+2NaOH═Na2CO3+H2O C+H2O![]() CO+H2 C+H2O
CO+H2 C+H2O![]() CO+H2
CO+H2
【解析】
①氧化反應不一定是化合反應,如甲烷燃燒生成二氧化碳和水,反應的化學方程式為CH4+2O2![]() CO2+2H2O。
CO2+2H2O。
②中和反應生成鹽和水,但生成鹽和水的反應不一定是中和反應,如CO2+2NaOH═Na2CO3+H2O。
③置換反應不一定有金屬單質生成,如碳與水蒸氣反應生成一氧化碳和氫氣,反應的化學方程式為:C+H2O![]() CO+H2(合理即可)。
CO+H2(合理即可)。
④堿和鹽反應可能同時產生兩種沉淀,如氫氧化鋇溶液與硫酸銅溶液反應生成硫酸鋇沉淀和氫氧化銅沉淀,反應的化學方程式為:Ba(OH)2+CuSO4=Cu(OH)2↓+BaSO4↓。
故答案為:
觀點 | 化學方程式 |
①氧化反應一定是化合反應 | CH4+2O2 |
②有鹽和水生成反應一定是中和反應 | CO2+2NaOH═Na2CO3+H2O |
③置換反應一定有金屬生成 | C+H2O |
④堿和鹽反應不可能同時產生兩種沉淀 | Ba(OH)2+CuSO4=Cu(OH)2↓+BaSO4↓ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:初中化學 來源: 題型:
【題目】在小英家的倉庫里,堆放著一袋袋化肥——碳酸氫銨(NH4HCO3)。過了一個夏天,小英發現這種化肥所持有的刺激性氣味變得更濃烈了,有些化肥袋里碳酸氫銨變少了,檢查發現變少的化肥包裝袋沒有密封,化肥沒有撒落在地上,也沒有人進過倉庫打開使用。為了探究這些化肥減少的原因,小英在實驗室取了一些碳酸氫銨粉末,放在蒸發皿中加熱,過一會兒觀察到粉末完全消失,同時也聞到了這種刺激性氣味。粉末為什么會消失呢?
(提出問題)碳酸氫銨粉末消失的原因是什么?
(猜想)①碳酸氫銨粉末在不加熱或加熱條件下由固態變成它的氣態。
②碳酸氫銨在不加熱或加熱條件下發生分解反應,可能產生的物質有氨氣和一些氧化物。
(查閱資料)①碳酸氫銨屬于氮肥,不具有升華的性質,說明上述猜想_____(填序號)不成立;②氨氣(化學式NH3)具有特殊的刺激性氣味,極易溶于水,其水溶液呈堿性,但干燥的氨氣不能使干燥的紅色石蕊試紙變藍;③NO2為紅棕色氣體。NO為無色氣體,在空氣中易發生反應:2NO+O2===2NO2 。
(實驗操作,現象與結論)
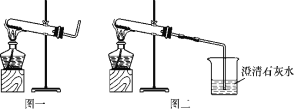
實驗操作 | 實驗現象 | 實驗結論 |
①取適量碳酸氫銨于試管中加熱,如圖一所示,將干燥的紅色石蕊試紙接近導管口 | 產生強烈的刺激性氣味,試管壁上有無色液滴且試紙變藍,但未見紅棕色氣體 | 分解產物中有____和__,沒有________________。 |
②按如圖二所示裝置繼續實驗,直到反應完全 | 澄清石灰水變渾濁 | 分解產物有___________。 |
(拓展應用)
①請寫出碳酸氫銨發生分解反應的化學方程式____________。
②寫出圖二中澄清石灰水變渾濁的化學方程式_____________。
③判斷:碳酸氫銨是否可用于實驗室制取氨氣?_______說明理由
④如果你家里有碳酸氫銨化肥,你應該如何保存?______________________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】已知所含元素化合價發生變化的反應是氧化還原反應,其中被還原的元素化合價降低,被氧化的元素化合價升高.海洋中有豐富的資源,如圖所示利用海水可獲得許多化工產品.下列有關說法正確的是( )

A. 第①步中除去粗鹽中的SO42﹣、Ca2+、Mg2+等雜質,加入的試劑順序為:NaOH溶液、Na2CO3溶液、BaCl2溶液,過濾后加鹽酸
B. 第②步中加入的試劑為CaCl2溶液
C. 第③步中發生氧化還原反應
D. 在第④步中溴元素被氧化
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】M是硝酸鉀或氯化銨中的一種,硝酸鉀和氯化銨的溶解度曲線如圖1所示,某化學興趣小組用物質M進行了如圖2所示的實驗.

(1)t1℃時,氯化銨的溶解度為_____g;
(2)燒杯①中溶質質量分數的計算式為_____;
(3)物質M是_____.
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】在相同質量、等質量分數的三份稀鹽酸中,分別加入①MgO,②Mg(OH)2,③MgCO3三種物質,均能恰好完全反應,分別得到三份無色澄清溶液.則所得溶液中MgCl2的質量分數大小關系的比較,下列正確的是( )
A. ①=③>②B. ①>②>③C. ③>②>①D. ①=②=③
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】室溫時,向盛有18.6g碳酸鈉和氫氧化鈉混合粉末的燒杯中加入100g稀鹽酸,恰好完全反應,得到114.2g該溫度下的不飽和溶液,則下列判不正確的是( )
A. 生成CO2為4.4g
B. 原固體混合物中鈉元素為9.2g
C. 所得溶液中溶質的質量為23.4g
D. 所加稀鹽酸的溶質質量分數為7.3%
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】人類發展的歷史進程中人們不斷研制出各種不同的用具,制造用具的材料也在不斷地發生變化,金屬制品因其美觀、耐用、輕便易成型而被人們廣泛利用,請根據所學知識及生活知識參與有關金屬制品探究。
(一)以下工具的制作過程中沒有發生化學變化的是_____。
A原始人制作石刀 B冶煉青銅 C煉鐵
(二)請將以下金屬材料的冶煉按年代的先后順序排序_____(填序號)。
A鐵 B青銅 C鋁
從以上順序可以看出,金屬制品的出現順序與_____有關,那么金屬鉀的制得應排在_____(填序號)之后。
(三)銅器是生活中常見物品,銅器保存不善,表面會生成一層綠色銅銹Cu2(OH) 2CO3.銅生銹的條件除了水和氧氣外還需要_____(寫化學式)。
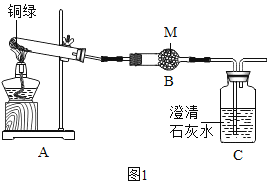
(四)為了探究堿式碳酸銅的化學性質和組成,該小組同學取少量銅綠(假設雜質不參與反應)按如圖裝置進行實驗:
已知:I.銅綠的主要成分是堿式碳酸銅。
Ⅱ.銅器因所處環境不同,生成的銅綠中可能還含有CuSO4和CuCl2。
Ⅲ.硫酸銅、氯化銅的化學性質穩定,酒精燈加熱條件下不分解。
(1)M藥品的名稱是_____。
(2)寫出Cu2(OH)2CO3分解的化學方程式_____。
(3)實驗過程中,發現A中綠色固體逐漸變為黑色,B中固體變藍色,C中現象為_____,此處發生反應的化學方程式為_____。
(4)為了驗證銅綠中是否有CuSO4和CuCl2,該小組同學進行了如下實驗,請補充完成下列實驗報告:
步驟 | 操作 | 現象及結論 |
① | 取少量銅綠溶于足量稀硝酸中,并將溶液分成甲、乙兩份 | 產生氣泡 |
② | 向甲中滴加硝酸鋇溶液 | 若觀察到_____,則銅綠中含有CuSO4 |
③ | 向乙中加入過量的硝酸鋇溶液,振蕩、靜置,取上層清液于試管中,再滴加_____。 | 若觀察到產生白色沉淀,則銅綠中含有CuCl2 |
(五)已知:
①銅礦礦石中含有Cu2(OH)2CO3及含鐵元素的雜質;
②黃銨鐵礬的化學式為 (NH4)xFey(SO4)m(OH)n,其中鐵為+3價。
③在化學中Fe3O4可以表示為FeOFe2O3
某興趣小組利用該銅礦石制黃銨鐵礬的流程如圖2:
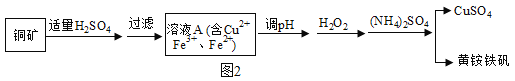
(1)以氧化物的形式表示Cu2(OH)2CO3的組成為_____,111gCu2 (OH)2CO3與稀H2SO4反應時消耗H2SO4的質量為_____g。
(2)該小組為測定黃銨鐵礬的組成,進行了如下實驗:
a.稱取mg樣品,加鹽酸完全溶解后,將所得溶液分為兩等份;
b.向一份中加入足量NaOH溶液并加熱,收集到0.0425g的氣體(假設氣體全部逸出)。將所得沉淀過濾、洗滌、灼燒至恒重,得到紅棕色粉末0.600g。
c.向另一份中加足量BaCl2溶液充分反應后,過濾、洗滌、干燥得沉淀1.165g。
①黃銨鐵礬中NH4+與SO42﹣的個數比為_____。
②通過計算確定黃銨鐵礬的化學式_____。(寫出計算過程)
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下列有關化學用語表示正確的是( )
A. 氯離子結構示意圖: ![]()
B. 2個氫原子:2H+
C. 酒精的化學式:C2H4O2
D. 氧化鈉中氧元素顯-2價: ![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com