
【題目】(一)“塑化劑”是一種重要的工業原料。已知一種塑化劑 (DMP)的化學式為C10H10Ox,其相對分子質量為194。據此計算:
⑴DMP中碳元素、氫元素的質量比為_____;
⑵DMP中碳元素的質量分數為_____;
⑶DMP的化學式為____。
(二)小紅同學在某化工廠進行社會實踐,技術員與小紅一起,分析由氯化鋇和氯化鈉組成的產品中氯化鈉的質量數。取16.25g固體樣品,全部溶于143.6mL水中向所得到的混合溶液中逐滴加入溶質質量分數為10.6%的碳酸鈉溶液,記錄了如圖所示的曲線關系。技術員給小紅的提示:反應的化學方程式BaCl2+Na2CO3===BaCO3↓+2NaCl
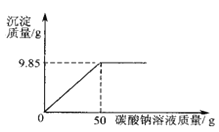
⑴當氯化鋇與碳酸鈉恰好完全反應時,消耗10.6%的碳酸鈉溶液的質量是— —— g。
⑵產品中氯化鈉的質量分數是多少?
⑶當氯化鋇與碳酸鈉恰好完全反應時,過濾,所得溶液中溶質的質量分數是多少?
【答案】(一)⑴12:1⑵61.9%⑶C10H10O4![]() (二)(1)50;⑵36%(3)5.85%
(二)(1)50;⑵36%(3)5.85%
【解析】
試題分析:DMP中碳元素、氫元素的質量比為=12×10:1×10=12:1;DMP中碳元素的質量分數為=120/194×100%=61.9%;因為(DMP)的化學式為C10H10Ox,其相對分子質量為194,所以194=12×10+1×10+16×X 解得X=4,所以其化學式為C10H10O4
設樣品中BaCl2的質量為x,生成NaCl的質量為y
Na2CO3 + BaCl2==BaCO3↓+2NaCl
106 208 117
50g×10.6% x y
列比例式得:106:50g×10.6%=208:X=117:Y 解得X=10.4克 Y=5.85克
產品中NaCl的質量分數為=(16.25克-10.4克)/16.25克×100%=36%
溶液中溶質的質量分數為![]()


科目:初中化學 來源: 題型:
【題目】美國銥星公司(已破產)原計劃發射77顆衛星,以實現全球衛星通訊,其要發射的數目恰好與銥 元素(Ir)的原子核外電子數目相等。下列關于銥元素的各種說法中正確的
A、銥原子的質子數為70 B、銥原子的相對原子質量為77
C、銥原子的核電荷數為77 D、銥元素為非金屬元素
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】元素周期表是學習和研究化學的重要工具,它的內容十分豐富。下表是元素周期表的部分內容,請認真分析并回答后面的問題:
IA | 0 | |||||||
1 | 1 H 氫 1.008 | 2 He 氦 4.003 | ||||||
IIA | IIIA | IVA | VA | VIA | VIIA | |||
2 | 3 Li 鋰 6.941 | 4 Be 鈹 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
3 | 11 Na 鈉 22.99 | 12 Mg 鎂 24.31 | 13 Al 鋁 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氬 39.95 |
(1)請從上表中查出地殼中含量最多的金屬元素的相對原子質量為 。
(2)表中不同種元素最本質的區別是 (填序號):
A.相對原子質量不同 B.質子數不同 C.中子數不同
(3)元素周期表中每一個橫行叫做一個周期,通過分析,同一周期元素之間的排列有一定的規律,如: (填字母序號)
A.從左到右,各元素原子的電子層數相同
B.從左到右,各元素原子的原子序數依次增加
C.從左到右,各元素原子的最外層電子數相同

(4)元素周期表中,原子序數為12的鎂元素的原子結構示意圖如右上圖,該原子在化學反應中易 (填“得到”或“失去”)電子。說明元素的化學性質與原子的 關系密切,由6、8、11號元素組成的物質的化學式是
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】右圖中每條連線表示兩端的物質可以發生化學反應,甲、乙、丙、丁分別為Mg、BaCl2、Na2CO3、HCl中的一種。請回答:

(1)寫出乙和丙的化學式:乙 ,丙 ;
(2)寫出甲和乙反應的化學方程式: ;
(3)丙和丁反應的現象為 。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】(一)根據下圖回答問題。
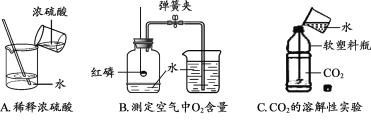
(1)實驗A中水作_________(填“溶質”或“溶劑”)。
(2)實驗B中發生反應的化學方程式為__________________________,集氣瓶中水的作用是____________。
(3)實驗C中的現象是_______________________________________。
(二).某學習小組對課本中“氯化鈉能用于制燒堿”的內容產生興趣,查閱資料得知:2NaCl + 2H2O 通電 2NaOH + H2↑+ Cl2↑。
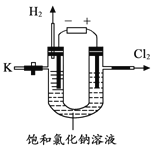
為驗證該反應能制燒堿,同學們用右圖裝置進行了電解飽和氯化鈉溶液的實驗,通電一段時間后,關閉電源,從K處倒出溶液作為待測液進行如下探究。
【探究一】檢驗待測液中含有氫氧化鈉
檢驗含有氫氧化鈉的方法是 。
【探究二】測定待測液中氫氧化鈉的質量分數
查閱資料:Ⅰ.氫氧化鎂不溶于水。
Ⅱ.氫氧化鈉與氯化鎂溶液能發生復分解反應,化學方程式為: 。
進行實驗:實驗步驟如下圖所示。

(1)步驟②加入的氯化鎂溶液必需過量,其目的是 。實驗過程中,判斷所加氯化鎂溶液是否過量的方法是 。
(2)實驗過程中若缺少步驟④的操作,則測定的待測液中氫氧化鈉的質量分數將 (填“偏大”、“偏小”或“沒影響”)。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】根據下列實驗裝置圖,回答有關問題。
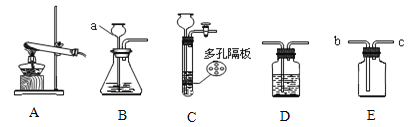
(1)寫出有關標號儀器的名稱a
(2)若實驗室用加熱氯酸鉀和二氧化錳混合物的方法制取氧氣,應選用的發生裝置是 ,該反應的化學方程式是 。實驗室用B裝置制取干燥的氧氣,還應選用D裝置,并在該裝置中盛放 (填試劑的名稱)。
(3)若用C來制取二氧化碳,則多孔隔板上應該放 (填藥品的名稱),請寫出實驗室制取二氧化碳的化學方程式 ,若用E裝置收集二氧化碳,則檢驗二氧化碳已經收集滿的方法是 。
(4)老師為同學們做如下實驗:A裝置的集氣瓶中裝有體積比約為1∶1的氮氣和氣體a的混合氣體,注射器中裝有足量的無色溶液b;B裝置中盛有少量紫色石蕊溶液;C裝置中盛有適量的鐵釘;D裝置中盛有足量的稀硫酸。
實驗步驟如下:關閉活塞K1、K2,將注射器中的溶液b擠入瓶中,打開活塞K1,看到B中溶液進入A中后溶液變為藍色,B中長導管脫離液面。一段時間后,再打開K2,觀察到D中液體進入C中。請回答:
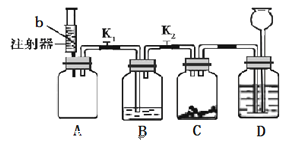
若a氣體是二氧化碳,則b是 溶液(填化學式);
若b是水,則氣體a可能是 (填化學式)。
裝置C中發生的化學反應的方程式為 。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下圖所示的是有關物質相互轉化的關系圖,其中A是一種金屬氧化物,G是紅褐色沉淀,I 的溶液呈淺綠色。

根據關系圖回答:
(1)若F是由Na+和Cl—組成的溶液,則:①甲是 ;②B+丙→F+G: 。
(2)若D是能使澄清石灰水變渾濁的氣體,則:①乙可能是 或 ;②I是 溶液。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】“化學反應條件的控制是實驗的靈魂”。某探究小組發現若反應過快,產生的氣體不易及時收集,為探究影響過氧化氫溶液分解快慢的因素,于是進行了如下探究:
【提出問題】過氧化氫溶液分解快慢與哪些因素有關呢?
【猜想與假設】猜想一:可能與過氧化氫的質量分數有關;
猜想二:可能與 有關;
猜想三:可能與是否用催化劑有關。
【設計并實驗】該探究小組用不同質量分數的過氧化氫溶液在不同溫度時進行四次實驗.記錄所生成的氧氣體積和反應所需時間,記錄數據如下表.
實驗 | 過氧化氫的 | 過氧化氫溶液 | 溫度 | 二氧化錳 | 收集氧氣 | 反應所需 |
① | 5% | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15% | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30% | 5 | 35 | 2 | 49.21 | |
④ | 30% | 5 | 55 | 2 | 10.76 |
【收集證據】要比較不同質量分數的過氧化氫溶液對反應快慢的影響,應選擇的實驗編號組合是
(選填“實驗序號”)。由實驗③和④對比可知,化學反應速率與溫度的關系是: 。
【解釋與結論】(1)通過探究,了解控制過氧化氫分解快慢的方法。請寫出過氧化氫溶液在二氧化錳的催化作用下生成氧氣的化學方程式為: 。(2)用一定量15%的過氧化氫溶液制氧氣,為了減緩反應速率,可加適量的水稀釋,所產生氧氣的總質量 。(填“減小”、“增大”或“不變”)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com